Vīrusi ir visur – tas, šķiet, nevienam nav nekāds jaunums, tāpat kā tas, ka vīrusi nav tikai cilvēku problēma – vīrusi ir arī mājdzīvniekiem, kukaiņiem, augiem. Tomēr, iespējams, mazāk zināms ir fakts, ka savi vīrusi ir arī baktērijām. Šos vīrusus parasti dēvē par bakteriofāgiem jeb vienkārši fāgiem (no grieķu val. phagein – ēst, tātad – baktēriju ēdāji). Pasaulē ir milzumdaudz baktēriju un vēl vairāk bakteriofāgu – tiek lēsts, ka kopējais to skaits varētu būt ap 1031 (tas ir vieninieks ar 31 nullēm), kas ir apmēram triljons reižu vairāk, nekā smilšu graudiņu uz zemeslodes. Fāga dzīves cikls no baktērijas inficēšanas brīža līdz jauna vīrusu metiena nākšanai pasaulē var aizņemt tikai pārdesmit minūtes, kas, apvienojumā ar to spējām strauji mutēt un pārkombinēt savu DNS, ir padarījis bakteriofāgus par ģenētiski visdaudzveidīgākajām radībām uz Zemes.
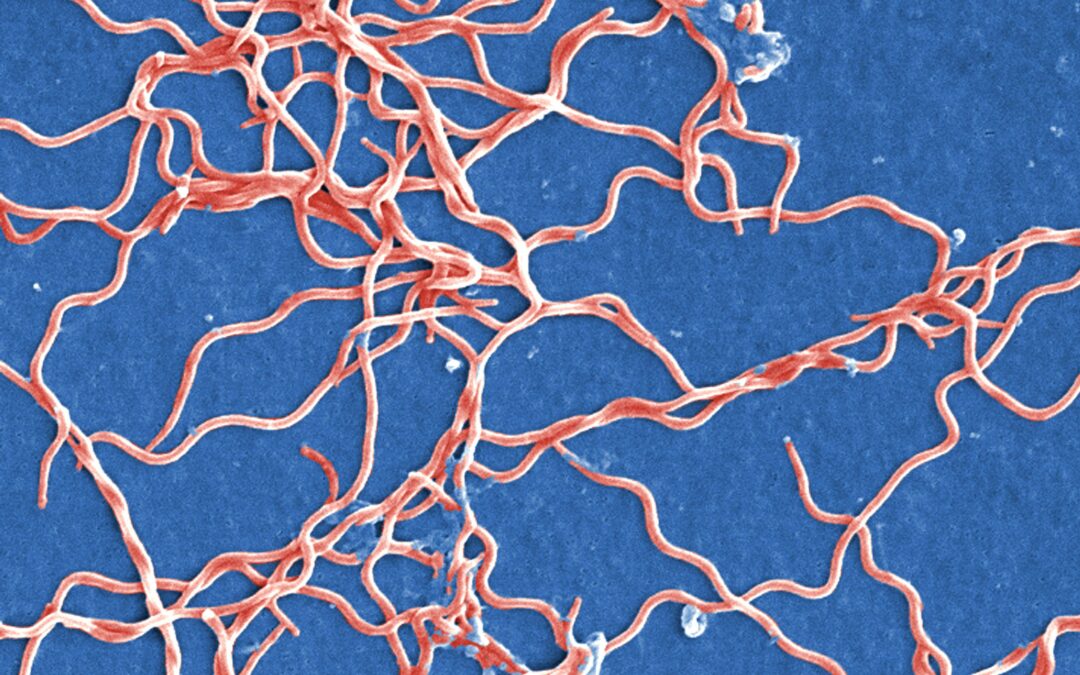
To iespējamā praktiskā pielietojuma dēļ, jeb vadoties pēc principa “mana ienaidnieka ienaidnieks – mans sabiedrotais”, visvairāk ir pētīti fāgi, kuri inficē dažādas patogēnas baktērijas, tomēr arī šajā jomā vēl aizvien pastāv diezgan lieli zināšanu robi. Tieši šāds gadījums ir bakteriofāgi, kuri inficē borēlijas – savdabīgas, sīkas spirāles vai korķu viļķus atgādinošas baktērijas (1. attēls), kuras pēc daudzām īpašībām ir unikālas citu mikroorganismu vidū.
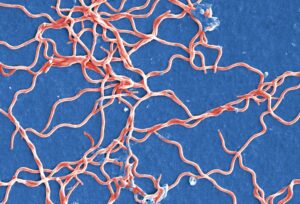
1. attēls. Borrelia burgdorferi baktērijas. Mākslīgi iekrāsots skenējošās elektronu mikroskopijas attēls. Attēla avots: https://pixnio.com/science/microscopy-images/borrelia-burgdorferi/grouping-of-gram-negative-anaerobic-borrelia-burgdorferi-bacteria
Borēlijas izplatās ar ērču starpniecību un izraisa Laimas slimību, ar ko Latvijā ik gadu saslimst vairāki simti cilvēku. Tā kā šīs baktērijas visu savu dzīvi pavada citā organismā – vai nu ērcē, vai zīdītājdzīvniekā – tad varētu likties, ka tās ir pasargātas no vīrusiem, tomēr tā gluži nav. Pirms vairāk nekā 20 gadiem tika atklāts, ka dažas no borēliju šūnās sastopamajām riņķveida DNS molekulām jeb plazmīdām īstenībā ir snaudoši bakteriofāga, saukta par φBB1, genomi. Bakteriofāgu vidū šāda prakse ir izplatīta: vīrusa DNS var ilgstoši uzturēties baktērijas šūnā, tikt kopēta kopā ar šūnas DNS, bet neizrādīt nekādas citas aktivitātes pazīmes, līdz kādā brīdī noteikti vides faktori to pamodina un sākas jaunu vīrusu veidošanās, šūnas sagraušana un jauno vīrusu atbrīvošana apkārtējā vidē. Līdzīgi kā endēmiskām sugām, kurām, ilgstoši attīstoties izolēti no citām, ir izveidojušās dažādas unikālas pazīmes – iespējams, zināmākais piemērs ir savdabīgā Austrālijas fauna –, arī φBB1 bakteriofāgs, ilgu laiku evolucionējot nošķirtībā kopā ar savu saimniekbaktēriju, ir kļuvis stipri atšķirīgs no citiem zināmiem bakteriofāgiem. Kopš tā atklāšanas φBB1 bakteriofāgs praktiski nemaz nav pētīts un gandrīz nekas nav zināms par daudziem tā bioloģijas aspektiem. Lai uzzinātu vairāk par šo neparasto vīrusu, projektā “Borrelia burgdorferi bakteriofāga strukturāli pētījumi” (projekta Nr. 1.1.1.2/VIAA/4/20/704) tika pētīta tā trīsdimensionālā struktūra.
Uzbūves ziņā bakteriofāgi ir daudzveidīgi un pieder pie dažādām grupām, kas katra evolūcijas gaitā gājušas savu ceļu. Visbiežāk izplatītais bakteriofāgu veids, pie kuras pieder arī borēlijas fāgs φBB1, ir tā saucamie astainie bakteriofāgi. Tā ir unikāla forma, kas raksturīga tikai mikroorganismu vīrusiem, un to veido galva jeb kapsīda, kam pievienota īsa vai gara, lokana vai stingra aste, kuras galā ir “taustekļi” jeb astes šķiedras, ar kurām vīruss atrod un pieķeras savam upurim – baktērijai (2. attēls). Vīrusa daļiņas izveidošanās ir daudzpakāpju process – vispirms izveidojas tukša prokapsīda, tad tajā tiek iepakots vīrusa genoms, neatkarīgi no galvas izveidojas astes komplekss, kas visbeidzot savienojas ar galvu, lai izveidotu jaunu, inficētspējīgu vīrusu. Bakteriofāgu daļiņas sastāv no dažiem simtiem līdz vairākiem tūkstošiem proteīnu molekulu no apmēram 20 dažādu proteīnu veidiem, kuri, veidojot vīrusu, savienojas viens ar otru kā trīsdimensionāli “puzles” gabaliņi. Daudzas detaļas, kā šis process molekulārā līmenī norisinās, vēl joprojām nav skaidras.
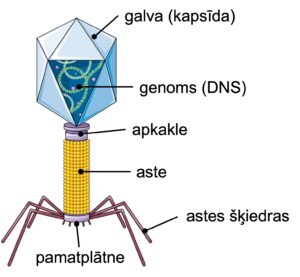
2. attēls. Astaino bakteriofāgu uzbūve. Attēla avots: https://quizlet.com/404666820/bacteriophage-structure-diagram/
Lai varētu pētīt bakteriofāgu struktūru, nepieciešams izšķirt detaļas, kas ir vairāk kā miljons reižu sīkākas par milimetru. To var izdarīt ar krio-elektronu mikroskopijas (krio-EM) palīdzību. Izmantojot šo metodi, pētāmais paraugs tiek sasaldēts plānā šķidruma slānītī, uzturēts vismaz -170 °C temperatūrā un, izmantojot jaudīgu elektronu kūli, iegūti attēli vairāk nekā 100 000 reižu lielā palielinājumā (3. attēls). No daudziem tūkstošiem interesējošā objekta attēlu iespējams izskaitļot to augstas izšķirtspējas trīsdimensionālo struktūru.

3. attēls. φBB1 bakteriofāga analīze krio-elektronu mikroskopā. Pa kreisi, Titan Krios krio-elektronu mikroskops CEITEC institūtā (Brno, Čehija), kurā tika iegūti φBB1 prokapsīdu attēli. (attēla avots: https://cryo.ceitec.cz/microscopes/) Pa labi, elektronu mikrogrāfija ar attīrītām φBB1 prokapsīdām. Lai aprēķinātu bakteriofāga trīsdimensionālo struktūru, tika iegūti vairāk nekā 7000 šādu attēlu.
Projekta ietvaros tika iegūtas un attīrītas φBB1 bakteriofāga prokapsīdas, un ar krio-EM palīdzību aprēķināta to trīsdimensionālā struktūra (4.attēls). φBB1 prokapsīda ir iegarenas formas un sastāv no sešu dažādu veidu proteīniem. Prokapsīdas galvenās sastāvdaļas ir t.s. galvenais kapsīdas proteīns, kurš daļiņā izkārtojas piecstūru un sešstūru veidā, un kapsīdu stabilizējošie proteīni, kuri apvienojas grupās pa trim un izdekorē prokapsīdas ārpusi. Prokaspsīda sastāv no 415 galvenā kapsīdas proteīna eksemplāriem un tikpat daudz stabilizējošiem proteīniem. Vienā prokapsīdas galā atrodas tā saucamais portāls – pora, caur kuru tajā tiek iesūknēts DNS. Šī struktūra sastāv no 12 portāla proteīniem, kuri ir simetriski izkārtojušies gredzenveida formā.

4. attēls. φBB1 bakteriofāga trīsdimensionālā struktūra. Kreisajā pusē attēlots daļiņas ārskats, labajā pusē skats ar paslēptu sektoru no ārējā slāņa, lai būtu redzami iekšpusē esošie proteīni. Galvenais kapsīdas proteīns attēlots dzeltenoranžā krāsā, trīs dažādie kapsīdu stabilizējošie proteīni zaļā, zilā un sarkanā krāsā, sastatņu proteīns fuksīna krāsā un portāla proteīns zilganzaļā krāsā.
Iespējams, visinteresantākā φBB1 prokapsīdas daļa ir tās iekšējās sastatnes. Daudziem mazākiem un vienkāršākiem vīrusiem kapsīdas proteīns viens pats spēj nodrošināt, ka, to molekulām savstarpēji saistoties, tās savietojas tā, ka automātiski izveidojas pareizās formas struktūra. Lielākiem un sarežģītākiem vīrusiem tas nenotiek tik vienkārši, un, līdzīgi kā ēkām, arī šādām kapsīdām to būvniecības laikā ir nepieciešamas sastatnes. Kā tieši molekulārā līmenī šis process norisinās, ir maz izpētīts jautājums bakteriofāgu bioloģijā. φBB1 prokapsīdas struktūra atklāja, ka daļiņas iekšpusē atrodas īpatnēja gredzenu grēda, kurā katru gredzenu veido 32 sastatņu proteīna molekulas, kā arī to, ka sastatnes sastāv no divām pretēji vērstām daļām, ar interesantu savienojumu starp tām. Struktūra arī parādīja, kādā veidā sastatņu proteīns saistās ar portālu un galveno kapsīdas proteīnu daļiņas iekšpusē. Šis ir pirmais gadījums, kad jebkāda bakteriofāga daļiņā ir novērotas šādas sastatnes. Kā zinātniskos pētījumos bieži gadās, jauni atklājumi rada jaunus jautājumus, un pagaidām nav skaidrs, kādā ceļā šī struktūra izveidojas – tas būs jānoskaidro turpmākos pētījumos. Bakteriofāgu genomu analīze rāda, ka sastatņu proteīni ir ievērojami mainīgāki kā galvenie kapsīdas vai portāla proteīni, tāpēc pagaidām nav arī skaidrs, vai šāda sastatņu uzbūve ir raksturīga tikai šaurai bakteriofāgu grupai, kuru pārstāv φBB1, vai arī tā fundamentāli ir līdzīga visiem šādas formas vīrusiem. Latvijas Biomedicīnas pētījumu un studija centrā ir izveidota plaša oriģinālu bakteriofāgu kolekcija, kura būs noderīga, lai turpmākos pētījumos varētu rast atbildi uz šo jautājumu.
Kopumā īstenotais projekts ne tikai ir uzlabojis izpratni par fundamentāliem bakteriofāgu uzbūves jautājumiem, bet tas arī paver iespējas turpmākiem pielietojamiem pētījumiem. Izmantojot φBB1 fāga augstas izšķirtspējas struktūru, iespējams apzināti pārveidot vīrusa proteīnus vēlamiem mērķiem – piemēram, kapsīdu stabilizējošiem proteīniem pievienot fragmentus no interesējošiem svešiem proteīniem un šādas pārveidotas daļiņas izmantot kā vakcīnas. Tāpat projekta gaitā ir veiktas iestrādes, lai turpinājumā varētu pētīt, kā φBB1 astes proteīni spēj atpazīt un saistīties ar borēlijas šūnas virsmu. Tas ļautu “aizņemties” un pārveidot attiecīgos fāga proteīnus, lai potenciāli izstrādātu jaunas Laimas slimības diagnostikas un ārstēšanas metodes. Projekta laikā apgūtās krio-EM prasmes arī ir ievērojami stiprinājušas BMC Strukturālās bioloģijas grupas spējas, kas būs nozīmīgas turpmāko pētījumu veiksmīgā realizācijā.
Raksts tapis projekta “Borrelia burgdorferi bakteriofāga strukturāli pētījumi” Nr. 1.1.1.2/VIAA/4/20/704 ietvaros.