Cilvēka ogļskābes anhidrāžu strukturālie pētījumi jaunu zāļvielu izstrādnei
Jānis Leitāns
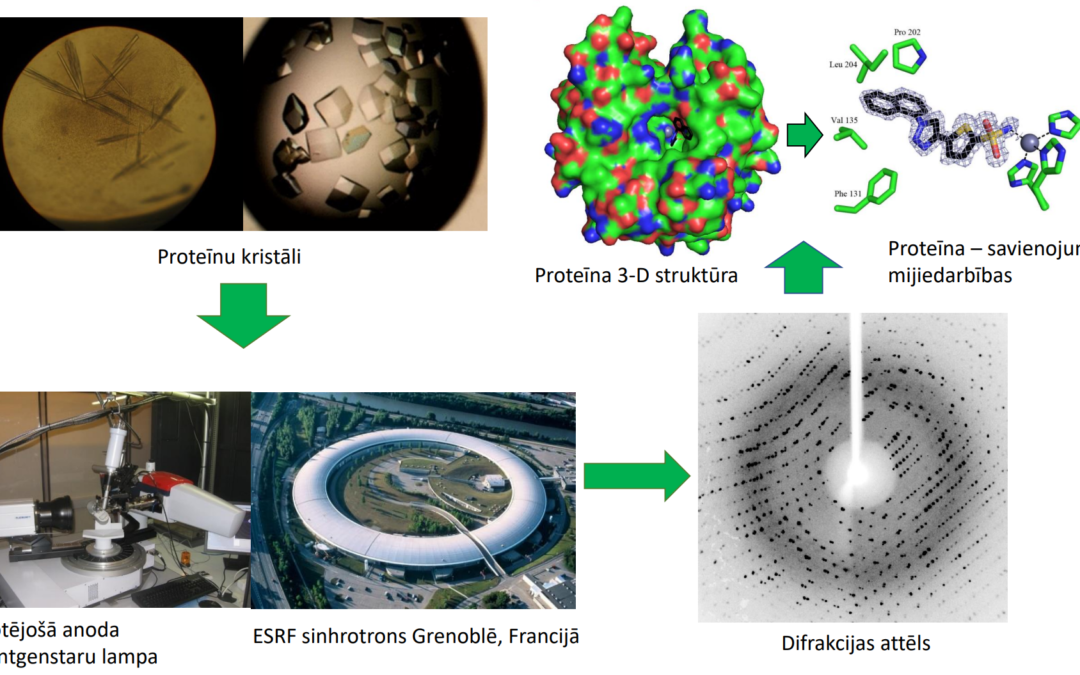
Cilvēku organismā ir tūkstošiem dažādi proteīni, daudzi no tiem ir enzimātiski aktīvi (paātrina kādas reakcijas norisi). Lai gan gandrīz visi proteīni cilvēkam ir nepieciešami, dažu enzimātiski aktīvu proteīnu darbība saistāma ar dažādām saslimšanām. Šo nelabvēlīgo proteīnu izpēte nepieciešama zāļvielu dizainam. Proteīni mūsu organismā ir telpiskas struktūras, katrs ar savu formu. Šo telpisko struktūru formas un īpatnības veido to funkcijas un mijiedarbojas ar citām molekulām. Ir vairākas metodes proteīnu 3-dimensionālās (3-D) struktūras noteikšanai. Proteīnu Datu Bankā (PDB) ir deponētas vairāk kā 200 000 proteīnu 3-D struktūras. 173 000 no tām (aptuveni 86 %) noteiktas ar proteīnu rentgenstruktūranalīzes metodi. Metodei nepieciešams proteīnu iegūt kristāliskā stāvoklī.
Tā kā kristāli veidojas ar zināmām simetrijām un tajās esošās molekulas tiek sakārtotas līdzīgi kā kieģeļi būvējot māju, šīs sakarības var izmantot molekulas radītā signāla pastiprināšanai. Lai iegūtu proteīnu kristālus, nepieciešams liels daudzums iegūta un attīrīta proteīna. Parasti nav iespējams prognozēt kristalizēšanās apstākļus un nākas pārbaudīt vairākus simtus dažādu apstākļu līdz tiek iegūts proteīna kristāls.
Kad kristāli iegūti, tos analizē ar spēcīga rentgenstaru avota – sinhrotrona (daļiņu paātrinātājs) vai rotējošā anoda rentgenstaru lampas palīdzību.
Proteīni sastāv no atomiem, atomos ir elektroni, kas rentgenstaru ietekmē izstaro sekundāros rentgenstarus. Tiem savā starpā mijiedarbojoties, ar jutīgu detektoru iespējams iegūt difrakcijas attēlu.
Proteīnu kristālu rotējot uz uzņemot tūkstošiem šādu dirfrakcijas attēlu, pēc datu apstrādes iespējams noteikt precīzu elektronu novietojumu molekulā. Tā kā atomiem ir konkrēts elektronu skaits (skābeklim 8, slāpeklim 7, sēram 16) ir iespējams noteikt precīzu katra atoma novietojumu un līdz ar to, proteīna struktūru. Nosakot proteīna struktūru, ir iespējams noteikt tā darbības mehānismus – ieraudzīt procesus atomārā izšķirtspējā.
Kā viens no “slikto proteīnu” piemēriem ir cilvēka oglskābes anhidrāzes IX izoforma (CA9). Tas ir sastopams gandrīz tikai un vienīgi audzēju skartajās šūnās un tā enzimātiskā darbība sekmē audzēju attīstību. Līdz ar to, tā selektīva inhibēšana (darbības apturēšana), spētu kalpot kā potenciālas pretvēža zāles.
Projekta laikā tika noteiktas vairākas 3-D struktūras ar vēzi saistītajam CA9 proteīnam kompleksā ar dažādiem savienojumiem. Nosakot precīzu savienojuma piesaistīšanās mehānismu enzīma aktīvajā centrā, tiek noteikts kā šī potenciālā zāļviela mijiedarbojas ar proteīnu un ir iespējams veikt secinājumus par potenciāliem uzlabojumiem.
Šis darbs tika īstenots ERAF projekta No. 1.1.1.2/VIAA/3/19/464 ietvaros.